Warning: main() [function.main]: open_basedir restriction in effect. File(../../../css/Menu.php) is not within the allowed path(s): (/mnt/159/sda/6/c/pichotjm) in /mnt/159/sda/6/c/pichotjm/Docu/Diatomees/1-CaptureDiatomees.php on line 16
Warning: main(../../../css/Menu.php) [function.main]: failed to open stream: Operation not permitted in /mnt/159/sda/6/c/pichotjm/Docu/Diatomees/1-CaptureDiatomees.php on line 16
Warning: main() [function.include]: Failed opening '../../../css/Menu.php' for inclusion (include_path='/mnt/159/sda/6/c/pichotjm/include:.:/usr/php4/lib/php') in /mnt/159/sda/6/c/pichotjm/Docu/Diatomees/1-CaptureDiatomees.php on line 16
Les diatomées
http://pichotjm.free.fr/Docv/Diatomees/1-CaptureDiatomees.php
Sommaire
Ce document représente mes notes privées au fur et à mesure de ma
découverte de
ce sujet.
Il y a donc eu des changements de méthode... Ce n'est pas un cours.
Il est sensé
me permettre de
trouver les diatomées du Lac Inlé. Pour
l'instant je suis plutôt en train de me noyer!
Cette page peut être longue à charger sur Internet. Elle est en réalité
prévue pour mon usage local (sur disque dur)
Je cite pour chaque photo:
| 1- L'auteur |
| 2- Le lien
correspondant vers le site LeNaturaliste (en cliquant sur
l'auteur) |
| 3- Le nom probable de la diatomée. Analyser
le lien indiqué (discussions) |
| 4- Le lieu de
capture |
(Ne pas oublier que je fais parfois des erreurs involontaires)
Références
Clé pour déterminer des
diatomées: http://www.inforef.be/projets/eureauforma/cle_diatom/numero/01.htm
Ref LeNat
Ref http://www.lenaturaliste.net/forum/
Ref Les diatomées vivantes: Les
chloroplastes des diatomées
Voir les livres de Päule: LeNat
Ref Livre: Atlas pour la détermination des diatomées /P
Lefébure 1947
E:\FTP_Pichotjm\Doc\Microscope\Livres\ATLAS_DIATOMEES_LEFEBURE_MED.pdf
Atlas des diatomées de la région Rhône-Alpes (6 tomes de
150MB): http://www.rhone-alpes.developpement-durable.gouv.fr/atlas-des-diatomees-de-la-region-a3480.html
http://www.microscopies.com/DOSSIERS/Magazine/Articles/D.Voisin-CLEDIA/
http://craticula.ncl.ac.uk/EADiatomKey/html/introduction.html
Formes et paramètres des diatomées *** : http://craticula.ncl.ac.uk/EADiatomKey/html/setcontents5.html
Base de données en ligne, Projet européen ADIAC
1- Récolte rapide en
déplacement
Voir LeNat
JMP:
Les vacances arrivent, et je voudrais être prêt pour prélever des
diatomées. Je pense particulièrement à des voyages lointains avec très
peu de possibilités. J'aimerai donc qu'on discute de la meilleure
méthode à suivre, sachant que je ne dispose d'aucun accessoire ni
produit, et que le temps à consacrer sera très faible (qqs minutes au
plus!) Et que l'ensemble final ne pourra pas dépasser 250 g.
Suite à mon expérience du Lac Inlé, je pense pouvoir avoir 2
bouteilles vides en plastic. Une sera découpée pour faire entonnoir et
bol pour verser de l'eau (l'épouse frottant les algues, j'arrose, et
récupère le liquide dans la bouteille). Je peux donc remplir 500 ml ou
1 litre. Cela doit pouvoir subir, ensuite, un peu de manipulation à
l'hôtel...
- décantation pendant la nuit?
- Transvasement du fond? Comment procéder? Car le fait de pencher la
bouteille et de verser, va remuer le fond... Faut-il un tuyau avec
seringue?
Quels sont les lieux intéressants? Lacs, étangs, rivières, ... ?
Faut-il des algues à proximité? Les lacs de très haute altitude
sont-ils intéressants? (>4000m) lacs de volcans?
Récipients de transport du concentré: les flacons à collyre
sont-ils un choix acceptable? (10 ml, Ils sont étanches dans les
avions). D'autres solutions sans investissements?
D'autres idées/sujets à aborder?
Le prélèvement
Si possible choisir des endroits avec algues ou mousses.
On aura soin d'avoir dans son sac à dos, 2 petites
bouteille à eau. L'une aura été découpée pour faire bol +entonnoir
(donc choisir des goulots différents).
Algues, mousses
Extraire les algues de l'eau et les frotter pour détacher
les diatomées. Pendant ce temps l'épouse/ami arrose avec de l'eau et
récupère également l'eau de lavage. Sur la terre ferme, il suffit de
poser la bouteille sur la berge, frotter les algues au dessus, et
arroser en récupérant l'eau de lavage.
Roches
Frotter les roches sorties de l’eau (brosse à dents)
Ou encore de prélever la surface de dépôts que l’on
aperçoit sur le sol dans les anfractuosités des creux de la mer, des
lacs ou des rivières. Ils contiennent en général beaucoup de diatomées,
mais également, souvent,énormément de détritus difficiles à éliminer
par la suite!
...
La précipitation
Il s'agit de tuer les diatomées. Mortes, elles ne
nageront plus et précipiteront au fond du récipient.
On peut tuer les diatomées avec de l'eau de Javel (10%),
ou de la Bétadine (2 ou 3 ml pour 250ml -à vérifier-).
La précipitation se fait au rythme de 45 mn par cm
de hauteur d'eau.
10 cm -> 7h30 13 cm -> 9h45mn
(cas d'une petite bouteille d'eau 250 ml)
Il importe donc de tuer les diatomées et de faire
précipiter le liquide dès l'arrivée à l'hôtel! (18h00 ->7h00)
On pourra utiliser comme récipients pour le transport du
concentré, des tubes à collyre
10 ml, des tubes à prélèvements sanguins 15 ml, des emballages de
pellicules Kodak, Agfa, ... Le tout pourra être mis dans une bouteille
plastique (conteneur complet et étanche) pour les transports en avion.
On se garantit ainsi contre les
fuites.
- Résultats expériences JMP: Pour une petite bouteille
à eau (250 ml ou 300 ml?), j'ai mis 10 ml d'eau de Javel prête à
l'emploi. Il y a eu précipitation. L'eau sur-nageante a ensuite été
traitée avec 20 ml de Javel (soit 30 ml au total). J'ai à nouveau
obtenu une précipitation (beaucoup plus faible) Il faudrait donc
utiliser de la Javel pure (Berlingot) 10 ml seraient suffisants. (à
vérifier la concentration Berlingot)
- L'action de la Javel: cela tue et ouvre les diatomées.
- Les mini bouteilles Schwepps sont idéales pour leur
solidité. Mais je ne peux pas y mettre mes flacons de liquides
concentrés! Heureusement il existe d'autre type de bouteilles à soda
qui sont solides. Les bouteille à eau sont trop fragiles.
Maraussan:
En situation urgence,
tu bouilles le tout un petit coup, fais reposer, enlèves le surnageant
au max.
Un peu de Bétadine ou de Javel pour éviter que la matière organique
n'entre en fermentation et décomposition (c'est très rapide, et ça pue
horriblement le poisson pourri).
L'avantage de la Bétadine est d'effectuer une fixation à l'iode, métal
lourd. Les spécimens sédimentent (allo ?).
Bons prélèvements.
L'extraction du concentré
Il s'agit de récupérer le fond de la bouteille, (genre 6
à 10 mm)
On va donc éliminer toute l'eau du dessus. Et le
siphonage reste la bonne méthode. On va donc se préparer un bouchon
spécial comportant un petit tuyau: droit et rigide pour aller jusqu'à 8
mm du fond de la bouteille, et un tuyau souple pour l'évacuation de
l'eau. La longueur de ce tuyau souple sera d'environ hauteur de la
bouteille + 20 cm. Il faut en effet que le tuyau débouche au moins 10
cm sous la bouteille pour avoir un débit suffisant. L'air doit pouvoir
entrer dans la bouteille.
Matériel nécessaire
1 bouteille avec 2 bouchons +1 bouteille différente
(goulot étroit)
Un tuyau rigide (genre 3mm de diamètre) et un tuyau
souple qui s'y emmanchera (diamètre genre 4 mm, 35 cm)
Un bouchon synthétique à vin. En couper 2 lamelles
de 5 mm d'épaisseur. Les transpercer au centre par une brochette en
bois afin de préparer le passage du tuyau rigide. Percer également un
bouchon de bouteille plastique. Y passer le tuyau rigide (paille fine).
Puis insérer de chaque coté les rondelles de bouchon. Il devient ainsi
possible de régler la paille pour n'arriver qu'à 6-10 mm du fond. Faire
un second trou pour laisser passer l'air (sinon la bouteille ne se
videra pas)
5 récipients étanches de 10 à 20 ml. L'un contiendra la
Bétadine. Les autres recevront le concentré des prélèvements. [On peut
aussi remplir chaque flacon de Javel pure/berlingot. Penser à placer le
tout dans une autre bouteille étanche]
...
2- Faire un prélèvement
Réponses de BelialL
- Frotter: avec le doigt? une brosse, qqs secondes ou
minutes? sec ou humide?
Une brosse à dent fait l'affaire, avec un peu d'eau et
normalement tu dois voir le biofilm qui est déposé sur la roche se
détacher.
surface des roches: là où il y a des algues? je
suppose.
Il y en a quasiment partout, mais le mieux c'est de
prendre les cailloux recouverts d'un peu de boue.
Algues: laminaire ou avec des petites poches
d'oxygène, ou genre mousse
Comme pour les roches, tu trouveras des diatomées sur
n'importe quelle algue ou en compressant les mousses.
Eau de Javel: concentration berlingot, ou diluée?
(comme pour un lavage à la main)
Peu importe, le but étant de vider les diatomées de leur
contenu cellulaire.
Quelques minutes suffisent, surtout avec le reste du traitement. Mais
tu peux la laisser plus longtemps afin de t'assurer que toute les
diatomées fixées sur l'algue sont bien détachées.
nettoyer les prélèvements: "à l'eau de Javel puis
lavages et eau oxygénée 35% au bain-marie..."? (comme expliqué)
Le but est de détruire la matière organique et d'éliminer
les particules. Il n'y a pas vraiment de protocole fixe et ça ne
fonctionne pas toujours aussi bien selon les prélèvements.
Tout ce que tu peux utiliser pour ça est bon à essayer, cependant,
l'eau oxygénée reste une constante en général étant donné qu'il s'agit
d'un très puissant oxydant et qu'elle est facilement accessible (7 € le
litre en grande surface).
y compris en MEB: Il va aussi falloir que je
réfléchisse à ne pas polluer une salle blanche de nanotechnologie... au
dégazage sous vide très poussé... métallisation?
Pour le MEB je ne peux pas répondre, je ne l'ai jamais
utilisé mais il s'agit de morceaux de verre donc on peut travailler
sous vide et la métallisation est nécessaire, je pense.
Observation possible sous banc macro avec reflex?
(avec JML 20x)
Le banc macro va être juste, tu verras les diatomées mais elles seront
trop petites pour discerner quoi que ce soit. Il faut les observer au
microscope.
Quelle quantité faut-il récolter pour avoir des
diatomées? 1 litre ou 1 cm3 ?
Tu peux déjà trouver pas mal de diatomées dans une seule
goutte d'eau !
Mais avec le traitement, il y a forcément des pertes à prendre en
compte et il vaut mieux en avoir une bonne quantité pour faire
plusieurs montage et avoir plus de chance de trouver les rares ! 
Après tout dépend de ce que tu récoltes, si tu prends bien la vase et
les algues que tu dilues dans un peu d'eau, tu vas en avoir beaucoup.
Si tu prends que l'eau de surface, tu en trouveras moins mais tu aura
moins de difficultés à les nettoyer !  BelialL
BelialL
Les traitements sont-ils à faire immédiatement?
Les traitements peuvent attendre, oui.
Pour exemple, ces diatomées du bassin ont attendu pas loin de deux
semaines dans le bocal avant que je m'y mette. 
Il y a aussi des diatomées en eau douce, un peu partout dans les mares,
étangs, rivières,...
Méthode 6le20
LeNat
... Mais je ne
sais comment les collecter, la côte est sableuse, où trouver des
diatomées ?
Je pratique la
chasse sous marine, est il possible de collecter de cette façon ? Si vous avez des
conseils...
Il y a deux types d'habitat : le plancton de pleine eau et le
benthos.
Pour les premières il suffit de faire passer de l'eau au travers d'une
maille fine et de recueillir le résidu et le fixer pour observation.
J'utilise une toile de 32 microns étalée dans une passoire et je verse
de l'eau dedans à l'aide d'un récipient quelconque. Attention, il faut
un peu s'éloigner du bord de plage pour ne pas avoir trop de grains de
sable. A défaut de toile calibré on peut utiliser n'importe quel tissu,
ou des bas, des collants, bref faire des essais. La fixation idéalement
se fait au formol, mais à défaut de l'alcool ménager peut faire
l'affaire.
Pour le benthos, n'importe quel fragment fixé de substrat dur convient.
Une petite touffe d'algue arrachée est largement suffisante pour
obtenir un univers de vie à l'échelle microscopique.
Faire tremper un objet
Si on dispose d'un étang, ou d'une plage privée, on peut
mettre (comme l'indique Dosso B: LeNat)
une tuile, un pavé, ... dans la mare en direction du soleil, et revenir
3 semaines après. Au moins, il n'y aura plus de sable dans le
prélèvement!
3- Extraction
et préparation
des lames de diatomées
Voir diatoms.pdf
Extraction: méthode Patrice Duros
LeNat
1- Pour ma part je réalise après le traitement par l'eau
de Javel
2- un tamisage à l'aide d'une passoire avec de fines
mailles, afin d’éliminer les "grosses particules".
3- Puis une série de lavage décantation (au moins trois)
en prenant soin d'éliminer les sédiments qui se déposent au fond du
récipient : petit grains de sable passés au travers des mailles de la
passoire... les diatomées plus légères se déposent plus lentement.
4- Ensuite, j'utilise l'acide chlorhydrique qui va se
charger d'éliminer les traces des particules organiques et minérales.
5- Enfin, lavages décantation (2) afin d'éliminer toutes
traces d'acide.
Voilà, voilà
Extraction: Méthode Toucan
LeNat
Voici quelques commentaires au sujet du traitement des
diatomées.
S’il s’agit d’un prélèvement dans de l’eau de mer : il faut remplacer
l’eau salée par de l’eau douce ; au minimum 4 lavage/décantation. (Cela
dépend évidemment des volumes utilisés)
1- Le traitement
à l’eau de javel permet notamment de précipiter les diatomées
qui adhéreraient encore aux algues dans le fond du récipient.
Eau de javel presque pure pour des diatomées d’eau douce et dilué 1/1
pour celle d’eau de mer.
Le traitement à température normale : durée 12 h.
2- Un tamisage est
nécessaire si le prélèvement comporte des grosses particules.
3- Ensuite une série de minimum 3 à 4
lavages/décantations pour éliminer l’eau de javel.
Les temps de décantation sont les suivants : ¾ d’heure
par hauteur en cm de liquide.
4- Le nettoyage. J’utilise pour ma part l’eau oxygénée à
110 volumes : 75% d’eau oxygénée 25% du prélèvement. Chauffer à environ
80°, durée de 1 à plusieurs heures, ou bouillir pendant 1 heure.
5- Lavage/décantation
(lavage en eau de distribution) 3 fois.
Examiner
sous le microscope l’état de propreté du prélèvement.
6- Si il est satisfaisant terminer le traitement par 2 lavage/décantation
dans de l’eau distillée.
A conserver dans 50% d’alcool à 90° ou simplement compléter le résidu
par de l’alcool à 70°.
Si le résultat n’est pas satisfaisant : 
7- Nettoyage à
base d’acide chlorhydrique à 10%. Chauffage : durée quelques
heures.
La propriété de cet acide est de réduire notamment le carbonate de
calcium.
Revenir aux points 5 et 6 pour terminer.
Remarques concernant le lavage/décantation.
La durée mentionnée au §3 permet un lavage optimum du
prélèvement.
Toutes les diatomées et objets non désirables (si l’eau est fort
chargée), se retrouvent dans le fond du récipient. 
Si l’on se trouve en présence de grain de sable il faut modifier la
façon de faire, lors du 3ème lavage, c’est à dire prélever le
surnageant (siphonner avec précaution) dès que le sable s’est déposé
dans le fond.
Examiner ensuite si on a bien recueilli l’ensemble des
diatomées qui se retrouvent dans le surnageant. Toutefois certaines
diatomées ont un poids équivalant au sable et se retrouvent aussi dans
le fond ; il y a lieu de recommencer des lavages/décantations
complémentaires sur ce résidu.
A quel moment prélever le surnageant ? C’est fort variable et c’est en
fonction du genre de prélèvement et de ce qu’il contient. C’est
toujours à contrôler sous le microscope.
Derniers conseils :
Ne pas hésiter à refaire une 2ème fois une étape de
nettoyage si on n’a pas obtenu un bon résultat la première fois.
On peut très bien permuter l’ordre des nettoyages « eau oxygénée » et «
acide chlorhydrique »
Quelques gouttes de formol permettent de conserver (indéfiniment ?) les
prélèvements non traités.
Amicalement Jean-Pierre
xxx
Méthode Jean Legrand
La préparation des diatomées
- le traitement: 10% eau de Javel concentré (2..3h),
tamis, lavages, acide, lavages, alcool)
- Le montage: lamelle, alcool +diatomées, calcination,
xxx
Méthode Dominique Prades
voir leNat
: Je vais un peu décevoir Jean B. en lui disant que je n'ai pas un
protocole fixe. Car ce que vous n'avez peut-être pas encore bien saisi
(normal pour les microscopistes qui ne nettoient pas des diatomées) est
que le problème
est variable suivant l'origine et la nature de la matière
organique récoltée avec les diatomées.Le traitement le plus facile d'un
prélèvement étant celui d'un grattage (avec une lame) de diatomées sur
les parois d'un aquarium par exemple.Un peu d'eau de Javel puis
rinçages et c'est propre.Ce n'est malheureusement pas toujours les cas
et dans mon exemple page 1 où il s'agissait de récupérer des frustules
d'Amphipleura épiphites, il était impossible de ne pas recueillir de
nombreuses particules de plantes.
Je commence toujours à la Javel (à froid) puis HCl (à froid) et
peroxyde
(de 1H à 3H à chaud). Après, je regarde au micro où celà en est. Puis (
en général ce n'est pas satisfaisant) c'est acide nitrique, lessive de
soude puis de nouveau eau peroxyde. Si celà n'est toujours pas
satisfaisant, après moult rinçages, j'utilise un mélange d'acide
sulfurique + cristaux de permanganate, je chauffe 15minutes. Si le
permanganate vire au marron, j'en rajoute, si il reste indigo je vais
décolorer cette mixture par un mélange de péroxyde+ HCl (2/3+1/3) puis
goutte par goutte, je rajoute celà dans la première mixture.
ATTENTION, la réaction est en général violente ( énormément de
mousse).(protocole lu ainsi que donné par mon ami Helmut Ullrich qui a
passé sa vie à traiter des diatomées).
En général c'est alors fini, mais il arrive qu'il reste encore quelques
infimes traces de débris, donc je recommence...
ATTENTION le peroxyde peut mousser beaucoup, même à froid (mais pas
systématiquement).
ATTENTION aux vapeurs de HCl et d'acide nitrique.
Il faut beaucoup rincer entre chaque chimie (surtout après la soude).
ATTENTION, toujours "travailler" avec des quantités réduites de
produit. (quelques ml)
Tout ceci concerne du matériel frais. C'est un peu différent pour du
matériel fossile.
Les petits tamis d'extraction cellulaire me sont fournis par un labo,
mais on les trouve sur Internet.
Voir LeNat
/DP. Sortir quasiment toute l'eau (il reste, suivant la
dimension du flacon, 5/8ml) et ajouter HCl très lentement (sans
dilution de l'acide), goutte par goutte au début (celà bien sûr peut
mousser s'il s'agit d'un prélèvement en eau calcaire ou marine. Dans ce
dernier cas, vous aurez préalablement pris la précaution de changer
l'eau de mer en eau douce avant toute chimie).
Oui, j'utilise depuis de longues années HCl vendu en magasin de
bricolage (normal, puisque j'ai lu ici même que je bricolais!!)
En fait, je n'utilise pas HCl (23% )pur. J'en rajoute autant qu'il
reste
d'eau au fond du flacon.
Pour le peroxyde, 110 volumes utilisés pur. (35% poids)
Pour le permanganate, suivant la quantité de matière encore à oxyder,
500mg à 1g. (rajouter si nécessaire)
Pour l 'hydroxyde de sodium (33% poids), à utiliser à 10% max.
Pour l'acide nitrique (53% poids) , eau 30% + acide 70%
Pour l'acide sulfurique (37%), 40% eau+60% acide (auxquels je rajoute
le KMnO4)
Pour finir, voici un aperçu de mon dernier petit bricolage. Ce sont des
diatomées que j'ai nettoyé avec les protocoles énoncés.
La prochaine fois, je tenterai la même chose avec des résidus de
calcination.  du new Land art en quelque sorte!!
du new Land art en quelque sorte!!
Préparation des frustules
Voir LeNat
LeNat
Articles à lire et à exploiter (à faire)
Extraits / D
Prades
Décantation:
.Le
temps de décantation sera proportionnel à la hauteur du liquide dans
ton flacon de traitement. Compter 45 minutes par centimètre et là,même
les plus petites diatomées seront au
fond.
Lavage: Le but du
lavage est de laver (ou de rincer) et donc d'éliminer (jamais
complètement en fait, théoriquement ) l'agent chimique utilisé.Cela
peut séparer par décantation fractionnée les frustules des "grains de
sable", mais cela ne séparera pas les frustules de la matière organique
encore non détruite. L'élimination du sable se fera par décantation ou
par tamisage.
Aspiration du surnageant:
Pourquoi ne peut-on pas jeter ce
surnageant en renversant doucement le récipient ? Parce que tu
pourrais remettre en suspension momentanée les frustules.L'aspiration
du surnageant (jusqu'à 3mm du sédiment) pourra se faire à l'aide d'une
grosse seringue de gavage (60ml).C'est la technique que j'utilise
depuis des années. Jamais je n'ai
utilisé l'ampoule à décanter de Christian puisque quasiment tous les
protocoles sont sur plaques chauffantes.
Attaques chimiques:
Enfin, je n'ai pu m'empêcher de
prélever quelques gouttes du dépôt après la première sédimentation et
j'ai remarqué encore beaucoup de débris végétaux. Dois-je recommencer
un traitement à l'eau de Javel ? Tu peux, mais ce sera du
temps perdu. Jamais tu ne détruiras à la Javel (berlingot) seule la
matière organique de ton prélèvement. Les micro-fragments de plantes,
la
vase des ports par exemple sont
extrêmement difficiles à éradiquer. Avec seulement de la Javel et du
HCL, tu ne feras pas grand chose puisque le but d'un traitement de
frustules est d'enlever par destruction TOUTE la matière organique et
non pas la plus grande partie de celle-ci (cela donne des lames où les diatomées
s'agglomèrent entre elles).
Donc je répète ce que j'ai dû écrire ici même et sur Mikroscopia.
Les outils et chimies du parfait petit diatomiste.
Les outils et chimies du parfait petit
diatomiste.
- Une grosse seringue.(aspiration du surnageant)
- Des flacons (type pots à confiture) bien épais (à
usage unique).Les préférer hauts, c'est important (suivant la quantité
de matière première), car le moussage peut monter (10/12cm). Attention
aux débordements!!!
- un prélèvement avec des diatomées :lol:
- Des tamis (de 35 à 250 microns)
- Peroxyde d'hydrogène (110vol.)
- Acide nitrique
- Acide chlorhydrique
- Acide sulfurique
- Permanganate de potassium en cristaux (sachets de
pharmacie)
- Lessive de soude
- eau déminéralisée
- J'utilise souvent la centrifugation ( centrifugeuse à
main ) et n'ai jamais constaté que cela cassait les diatomées, même les plus fines)
Note sur le Ph
6le20:
effectivement le critère PH est sérieusement à prendre en compte :
- Thiosulfate de Sodium Ph 8,6,
- Eau javel ph >11;
- Eau oxygénée ph 4,5.
Je viens de trouver la méthode de toucan qui n'utilisait que de l'acide
chlorhydrique et de l'eau oxygénée. LeNat
PierreM:
L'eau oxygénée est de pH
acide, donc plus intéressante que l'eau
de Javel.
Pour éliminer les carbonates, il vaut mieux l'acide chlorhydrique ou l'acide acétique.
L'acide sulfurique est souvent
conseillé, dans le cas de sédiments calcaires c'est une erreur car on
risque de se retrouver avec un précipité de sulfate de calcium
difficile à éliminer.
L'acide nitrique est plus
dangereux et plus difficile à se procurer. LeNat
A
Maraussan:
bases et acides forts peuvent abimer les diatomées, radiolaires et
spicules de silice. On peut l'observer à des grandissements extrêmes en
microscopie optique, et plus facilement au microscope électronique.
C'est l'eau oxygénée qui apparait comme étant la plus respectueuse des
structures.... LeNat
Préparation par AS Sterrenburg
Le montage des lames: méthode toucan pour diatomites
Voir chapitre diatomites
Le montage des
diatomées.
J’ai constaté à maintes reprises qu’il était difficile
d’avoir une bonne répartition des diatomées sur la lame : soit des agglomérats localisés soit une
concentration excessive sur le pourtour de la goutte déposée.
Voici la façon dont je procède et qui me donne de bons résultats.
J’utilise de grandes lamelles de 22x22 mm. nettoyées à l’alcool à
brûler.
Je place mes lamelles sur une plaque chauffante froide.
(J’utilise une petite grillade électrique avec thermostat achetée pour
quelques euros dans une grande surface)
J’ai dépose 2 gouttes d’eau déminéralisée et ensuite j’y dépose dessus
3 gouttes d’alcool qui foisonnent et étalent la grosse goutte obtenue
sur une plus grande surface.
Enfin sur cette grosse goutte j’y dépose 1 goutte de diatomée.
Les diatomées se répartissent bien sur
toute la surface de cette grosse lentille. (Pour rappel : cette
goutte de diatomée est composée par moitié d’eau
déminéralisée et par moitié d’alcool)
Ensuite je chauffe la plaque doucement en jouant sur le thermostat de
sorte que la plaque chauffe très lentement au début (on voit que les diatomées s’agitent et se déplace un peu),
ensuite je porte la température au environ de 70 à 80°C (ici les diatomées ne bougent plus) que je laisse
refroidir doucement et je répète cette procédure jusqu’au séchage
complet.
J’estime que cela dure environ une dizaine de minutes.
La suite du montage est comme il est d’usage : la lame reçoit 2 à 3
gouttes de Styrax, Zrax ou Naphrax en son centre et on y dépose avec
soin la lamelle. On chauffe la lame doucement à environ 50°C. Jusqu’à
bullage de la résine et donc l’évaporation du diluant (Xylène, Xylol,
etc.…). Placer un petit poids sur la lamelle pour assurer une épaisseur
minimum de résine.
Mon expérience avec le Zrax me permet après 3 ou 4 jours de manipuler
la lame sans risque sous le microscope. Avant cela il faut être très
prudent lors de l’utilisation d’objectifs à fort grossissement, très
proches de la lamelle. /toucan
PS La colle Uhu
Hart serait comparable à du Zrax: LeNat
En 2011, le plus simple est de commander du Zrax
(indice optique 1.70) à dailey@sas.upenn.edu, 40US$ la bouteille de
25cl, le solvant étant à rajouter lors de la réception. Le protocole de
montage ... http://micrap.selfip.com:81/micrapp/media.htm
...
Montage au Zrax
Preparing a Working
Solution of Zrax
In the U.S., Zrax is currently supplied as a solid resin in
clear one ounce bottles and must be dissolved in toluene prior to use.
Toluene is available as a paint thinner in most hardware and paint
stores. The unfilled portion of the bottle is filled with toluene and
mixed several times a day over the course of several days until a
homogeneous solution results. For use, a portion of this solution is
transferred to a separate container and additional toluene is added
until a freely dropping solution results.
Making Microscope Mounts with Zrax
Several methods for making microscope mounts with Zrax may
be used. All require some form of heating to remove the toluene
solvent. The most convenient form of heat is a hot plate set close to
the boiling point of water (100°C). Several drops of diluted Zrax are
placed onto the slide which is then gently warmed until most of the
solvent has evaporated. The cover with sample is placed onto the resin
and heating is continued overnight. Prolonged heating at these
temperatures does no harm. For samples that are mounted directly onto
the slide, several drops of diluted Zrax are dropped onto the sample
and the solvent is removed by warming on the hot plate. The cover is
placed onto the resin and heating is continued overnight.
Excess mountant is easily removed from the cooled slide by a
single-edged razor blade.
Ringing the slide cover is not necessary.
LeNat
You will need to add toluene or other organic solvent to
dissolve the resin before use.
...
If you are unable to locate toluene, you can substitute Xylene (Xylol).
However you will need to warm your slides to a slightly higher
temperature to cure them since xylene boils at a higher temperature
than toluene. Another solvent you can use is pure acetone. Make sure
that you use pure acetone and not a product that has water in it or
that will spoil slides. DON'T use alcohol or turpentine or mineral
spirits, etc. They won't dissolve the Zrax and will cause problems.
Durcir le Zrax
Note Dominique Prades: LeNat
Au sujet du Zrax (et idem pour le Pleurax)..
Si vous faites des lames étendues, elles doivent être
sèches 15 minutes après la dépose de la goutte de médium et pose
de la lamelle.
Pour cela, vous devez les chauffer soit sur
plaque d'acier
sur un feu de gazinière (le petit) ou bien si vous ne faites qu'une
lame, une petite plaque de métal que vous disposez 10mm sous l'ampoule
halogène d'une petite lampe de bureau.Vous aurez quelques instants
après un très fort dégazage.Quand celui se calme, laissez encore
quelques minutes puis attrapez sans se brûler la lame avec une pince et
le médium est dur à coeur. La semelle d'un fer à
repasser est aussi une alternative valable.
Le médium des préparations "artistiques" est mou car je chauffe
beaucoup plus doucement . la zone marginale lame/lamelle devient un peu
dure afin que je puisse luter, mais si on chauffe trop, le dégazage est
tellement violent qu'il pourrait faire bouger les frustules. A éviter.
Produits pour monter des lames
- Le verre/diatomées ayant un indice de n=1.51, il faut
donc monter les lames avec un indice supérieur, d'où le grand intérêt
du Zrax (n=1.74)
| Nom |
indice |
Prix |
Diluant
|
| Baume Canada |
1.59 |
|
Xylol (Xylène) et
Toluène |
| Caedax |
1.56 |
|
|
| Dirax C |
1.59 |
|
|
| Euparal |
1.48 |
|
Isopropanol |
| Naphrax |
1,66/1,73 |
|
Xylol (Xylène) et
Toluène |
| Pleurax |
|
|
|
| Storax |
1,68 |
68 FS/100g |
Xylol (Xylène) et
Toluène |
| Styrax |
1,58/1,68 |
|
Xylol (Xylène) et
Toluène |
| Syrax |
1,68 |
|
Xylol (Xylène) et Toluène |
| Zrax |
1,74 |
|
Xylol (Xylène) et
Toluène |
| Réalgar |
2,55 |
|
|
| Verre |
1.515 |
|
Acide fluorhydrique ;-) |
- Voir la page http://www.brunelmicroscopes.co.uk/coverslips.html
- Zrax: 40+0$ http://micrap.selfip.com:81/micrapp/media.htm
- En 2011, le plus simple est
de commander du Zrax
(indice optique 1.70) à dailey@sas.upenn.edu, 40US$ la bouteille de
25cl, le solvant étant à rajouter lors de la réception. Le protocole de
montage est simple. l'indice de 1.70 n'est obtenu qu'une fois
le solvant évaporé. L'idéal consiste à maintenir la préparation montée
A PLAT, sans luttage, pendant un temps certain... Voir LeNat
/Maraussan
- Toluene may
still be available in your local
hardware and paint stores as a thinner or degreaser.
- If you are unable to locate toluene, you can
substitute Xylene (Xylol).
However you will need to warm your slides to
a slightly higher temperature to cure them since xylene boils at a
higher temperature than toluene.
- Another solvent you can use is pure acetone. Make
sure that you use pure acetone and not a product that has water in it
or that will spoil slides.
- Diatoms require mountants
with a very high refractive index in order to resolve internal
structures. Brunel Microscopes have two specialist alternatives. Both
these are available exclusively from Brunel Microscopes Ltd.
- Storax - refractive index 1.68 CMS21 - £6.95
per 15mls
- Naphrax Diatom
Mountant Naphrax in
particular has received international recognition as the mountant of
choice for diatoms.
For further information about Naphrax and
how to order click here Naphrax UK -
refractive index 1.73 CMS22 - £29.16 per 15ml CMS23
- £225.00 per 250ml Naphrax Export - the solvent used in the production of
naphrax is toluene. Air transport
regulations do not allow the carriage of toluene for safety reasons.
Due to the popularity of this diatom mountant world wide, we have
developed export packs of the resin without the toluene that can be
added on receipt. Reconstitution instructions included. CMS22EX - £29.00 per 15ml CMS23EX
- £215.00 per 200ml
- Vente Brunel: Naphrax
34.22+tva8.38+port7.67=50.27€
- La résine la plus facile a obtenir est le Naphrax (chez Brunel). Son indice de
1.66 est excellent pour les diatomées.
Le Zrax, actuellement très difficile à
obtenir, monte à plus de 1.70. Sinon il reste le Pleurax, mais je n'ai pas d'adresse.
- Styrax
which has a refractive index of 1.58. It is especially useful for
highly silicified forms like those found in fossil marine samples. It
is available from Dr. Stephen Nagy who maintains the Montana Diatoms page.
- Another excellent diatom mounting medium is Styrax which has a refractive index
of 1.58. It is especially useful for highly silicified forms like those
found in fossil marine samples. It is available from Dr. Stephen Nagy
who maintains the Montana Diatoms page. Other information and
products related to diatoms will be found here, as will some beautiful
pictures of spectacular arranged diatom microscope slides.
- Les colles Uhu
Por (Zrax) ou Uhu Hart (Zrax) conviendraient...
Voir LeNat
/Maraussan (c'est incompatible avec toute trace d'humidité LeNat)
- De mon coté, faute de mieux, j'ai testé le cyanoacrylate (la super glue) !
C'est pas si mal et ça à l'avantage d'être très simple à utiliser et
super facile à trouver. Ça me permettra de me faire la main !
- Milieu de montage de diatomées: LeNat
- Photo aux UV (indices en UV):
E:\FTP_Pichotjm\Docu\Diatomees\UV-diatoms-2011.pdf UV-diatoms-2011.pdf
- Cette histoire de
température expliquerait les déboires de certains avec le xylène (la
préparation se troublant après un certain temps si mes souvenirs sont
bons ?)
Non, ce n'était pas avec le Zrax, mais avec le Syrax/Sirax (2 indices
différents).
Stephen Nagy ne vends rien. Il étudie néanmoins les diatomées de
St-Laurent-la-Vernède, site II... LeNat
Jean-Marc :
Celles-ci doivent être montée sur lamelle et pas sur lame, dans un
milieu à haut indice de réfraction, supérieur à 1,7 : Naphrax, styrax,
réalgar...
OK pour le Naphrax, dont l'indice de réfraction est juste limite à 1.70
solvants totalement évaporés, et pour le Réalgar (un composé d'arsenic,
interdit depuis des lustres en labo), dont l'indice de réfraction est
un champion à 2.55.
Pas OK pour le Styrax, le Styrax extrait de l'arbuste Stirax orientalis dont l'indice de
réfraction est seulement de 1.58 solvants totalement évaporés, et idem
pour le Styrax extrait de l'arbuste Stirax
styraciflua dont l'indice de réfraction est seulement de 1.63
solvants totalement évaporés. Ces deux résines présentent néanmoins des
indices supérieurs à celui du Baume du Canada (1.53).
Le Styrax étant très souvent confondu avec le Syrax ou Storax des très
anciens manuels, résine de Benjoin extraite de l'arbuste Styrax tonkinensis dont l'indice de
réfraction est de (je vous le demande *...) solvants totalement
évaporés.
J'en conviens, c'est un peu hard. Les mesures sont certifiées, prises,
reprises et validées en 2015 pour MNHN.
1.80 comme par hasard ! Maraussan LeNat
Compléments
- Merci beaucoup pour cette description de la
procédure beaucoup plus détaillée que la mienne. Il est vrai que je
procède au remplacement de l'eau salée par de l'eau douce pour les
diatomées marines. Je n'ai pas d'eau oxygénée 110 volumes, est ce plus
efficace que l’utilisation de l'acide chlorhydrique en première
intention ?
- L'eau oxygénée à 110 volumes se retrouve dans les
Brico. Elle sert je crois surtout à décaper la peinture sur les vieux
meubles.
Attention ce produit concentré provoque de graves
brulures. 
Par rapport à l'HCl les vapeurs ne sont pas aussi nocives.
En général, j'utilise les 2 produits car mes prélèvements sont rarement
limpides! 
Amicalement
Jean-Pierre
...
Gisements de diatomées
http://terrediatomee.fr/
Tu pourrais aussi aller vers Bernasso, Andance ou
Saint-Laurent-la-Vernède, sites classiques et pas trop éloignés de ton
secteur.
Il y a eu de nombreux échanges dans le forum à leur sujet. LeNat
...
Vente de lames
4- Observation de
diatomées
Méthode Toucan
Matériel
Pour répondre à la question du matériel que
j’utilise pour réaliser les photos des diatomées voici :
En général le microscope Orthoplan trino avec les optiques suivantes
- 10x Leitz NA 0.30 plan fluotar
- 20x Lomo NA 0.65 Apo
- 40x Leitz NA 0.95 Apo
- 63x Zeiss NA 1.40 Plan Apo ph3 oil
- 100x Leitz NA 1.32 Plan Apo oil
Et pour les prises
de vue:
Le Canon EOS 40D utilisé en LiveView, très facile pour des séries
d’images à stacker ensuite.
Et depuis quelques jours la caméra ToupView UCMOS14000 (de qualité
exceptionnelle)
Je dois aussi ajouter que j’utilise couramment le programme de
Photoshop pour améliorer, si nécessaire, quelque peu l’image et
notamment pour gommer les fonds « encombrés ».
...
Méthode Päule
JMP:
C'est vraiment très beau! Bravo.
Un peu de détail sur le matériel utilisé? objectif, ouverture, DIC, ...
Päule:
Voici quelques informations : Pour la dernière photo j'ai utilisé mon
Zeiss (ouest) Standard 18 avec l'ancien DIC.
- Objectif : Zeiss Jena Apochromat 40x / 0.95
- Oculaire : Zeiss (ouest) S-kpl 10/20 (lunettes)
- Fototube : Zeiss (ouest) avec optique 0,25x
- Caméra : Canon EOS 500 D
JMP:
Tu mets l'oculaire s-kpl dans le tube trino? Réglage pour une vision à
l'infini?
Puis montage par dessus avec le phototube 0.25x?
Comment interpréter la valeur 0.25x? (par rapport à un 10x? 10x
multiplié par 0.25x = 2.5x ?) Je n'arrive pas à comprendre. Mais ce
n'est pas très grave!
L'important est l'utilisation d'un 40x/0.95 sec.
Päule:
Tu mets l'oculaire s-kpl dans le tube
trino? -> OUI !
Réglage pour une vision à l'infini?
-> NON - il ne s'agit pas d'un système infini !
J'étais également surpris par la qualité du 40 sec. Je trouve qu'il est
mieux que le Zeiss Ouest 40 achromat que l'on m'avais proposé. Et le 63
/ 0.95 Apochromat de Zeiss Jena fonctionne aussi bien avec l'ancien DIC
ainsi que le superbe Planapochromat 63 / 1.4 de Zeiss Ouest. Je crois
que c'est ça, l'avantage de l'ancien DIC, que l'on peut utiliser
d'autres objectives que des origines... LeNat
JMP:
Fais-tu du stacking pour obtenir un tel résultat? 
Si c'est le cas, et compte tenu de la qualité, il serait tentant de
faire un essai de vision 3D... Je veux bien essayer si tu me
communiques les photos élémentaires.
Päule:
Pour les diatomées je fais toujours des stacks d'environ 30 à 120
photos avec Helicon Focus. Mais après avoir enregistré le résultat je
les supprime immédiatement pour qu'elles n'occupent pas trop de mémoire.
Avec Helicon Focus je peux aussi faire des photos en vision 3D et je
l'ai déjà essayé, mais les résultats étaient peu réalistes...
...
Méthode xxx
...
5- Diatomées des Lac Inlé
(Birmanie) et Mytavn (Islande)
La
zone comportant les photos (trop lourde) a été déplacée ici: http://pichotjm.free.fr/Docu/Diatomees/2-CaptureDiatomees.php
...
Une exploration des lames montre que énormément de
genres de diatomées d'eau douce sont présentes dans ce prélèvement/
-Fragilaria,(synedra)
-Cocconeis
-Achnanthes
-Cyclotella
-Cymbella
-Eunotia
-Gomphonema
-Gyrosigma
-Navicula
-Epithemia
-Nitzschia
-Neidium
-Pinnularia
-Rhopalodia
...et il en manque certainement !
Une particularité : elles sont toujours très
petites. /André LeNat
Description
.
...
...
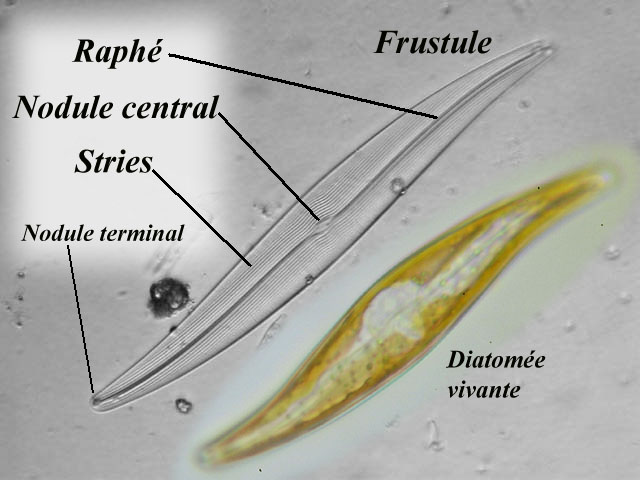
Bandes Hyalines
Frustule
- Les diatomées sont des algues unicellulaires
planctoniques dotées d’un squelette extérieur en silice, transparent et
rigide, appelé frustule.
- Chaque frustule est une structure en silice formée de
deux coques ou thèques maintenues par une bande siliceuse. De nombreux
orifices très fins, les pores traversent le frustule, leur taille varie
selon les espèces de 50 à 200 nanomètres.
- Cette enveloppe ou frustule est constituée de silice
faiblement cristallisée, semblable à du verre. Fondamentalement, le
frustule se présente comme une boite : il se compose de deux parties,
le couvercle et le fond, s'emboîtant l'une dans l'autre. On distingue
la vue du couvercle ou valve de la vue de "coté" ou les deux valves
s'emboîtent, la première est dite vue valvaire et l'autre la vue
connective. D
Voisin
- JMP:
Le matériau ressemble à du verre, il peut donc être mis en contact avec
des acides ou des bases.
Pores
De nombreux orifices très fins, les pores traversent le
frustule, leur taille varie selon les espèces de 50 à 200 nanomètres.
Raphé
Bande centrale visible. Le raphé est interrompu en
son milieu par un épaississement siliceux, le nodule central et se
termine aux deux extrémités par un nodule terminal. Certaines diatomées
n'ont qu'un raphé atrophié on parlera alors de pseudo raphé de même que
l'absence de raphé chez d'autres les classeront dans les araphidées ou
crypto-raphidées. D
Voisin
Thèques
Chaque frustule est une structure en silice formée de
deux coques ou thèques maintenues par une bande siliceuse.
...
Voir http://craticula.ncl.ac.uk/EADiatomKey/html/taxa.html
Glossaire de D Voisin
Par Dominique
Voisin
Aire centrale : partie centrale
de la valve sans ornementation.
Aire longitudinale : partie de
l'axe longitudinal de la valve sans ornementation.
Aire transversale : partie de
l'axe transversal de la valve sans ornementation.
Canal raphéen : sorte de tube
cylindrique sur lequel se trouve le raphé.
Ceinture connective ou cingulum
: bande entourant la cellule et située à la jonction des deux valves.
Valve isopolaire : cellule
présentant une forme identique de chaque côté de l'axe transapical.
Valve hétéropolaire : cellule
présentant une forme différente de chaque côté de l'axe transversal.
Diatomée centrique : diatomée de
forme ronde ou cylindrique.
Epivalve : partie supérieure du
frustule ("couvercle").
Fibules : épaississements de
silice chez les Nitzschia, localisés généralement en bordure de valve.
Frustule : ensemble des deux
valves (épivalve et hypovalve). (voir image en dessous)
Hypovalve : partie inférieure du
frustule ("fond")
Nodule central : épaississement
siliceux situé entre les pores centraux du raphé.(voir image en dessous)
Nodule polaire ou terminal :
épaississement siliceux situé au niveau de la terminaison polaire d'une
branche de raphé.(voir image en dessous)
Pennée : diatomée de forme autre
que ronde et cylindrique.
Pseudoraphé : zone définie par
l'interruption des stries dans l'axe longitudinal de la valve.
Raphé : fente située dans l'axe
longitudinal de la valve et permettant des échanges entre la cellule et
le milieu extérieur.(voir image en dessous)
Stauros : zone définie par
l'absence de strie au niveau des axes longitudinal et transversal et
formant ainsi une croix.
Stigma : ornementation formée
d'un point dans l'aire centrale de certaines diatomées.
Stries lignées : stries formées
de petites fentes bien nettes et orientées dans le sens longitudinal de
la valve.
Stries longitudinales : stries
dont la disposition est telle qu'elles apparaissent rangées plus ou
moins parallèlement à l'axe longitudinal ou à la marge.
Stries ponctuées: stries formées
de points placés les uns à côté des autres.
Stries transversales : stries
dont la disposition est telle qu'elles apparaissent rangées plus ou
moins perpendiculairement à l'axe longitudinal ou à la marge.
Stries radiales : chez les
Centriques, stries convergeant vers le centre.
Stries radiantes : chez les
Pennées, stries convergentes vers le centre.
/ Dominique
Voisin
...
Etude de luminescence
Voir http://mavoiescientifique.onisep.fr/le-blog-de-la-science/les-diatomees-algues-unicellulaires-nanostructures-electro-optiques-de-demain/
...
6- Diatomées fossiles
LeNat
- effectue une recherche web sur le mot diatomite...
Certaines sont horriblement compactes (comme à Oamaru) et rendent
l'extraction longue et difficile, d'autres sont particulièrement
meubles (comme à St Laurent la Vernède) et un simple lavage à l'eau
oxygénée ou au Blanco peut suffire. /Maraussan
- Diatomées fossiles de Saint-Laurent-La-Vernède (Gard)
LeNat
Localisation, cartes, ...
- Voici les premières diatomées que j'ai récolté et
positionné .Par congélation et décongélation rapide, j'ai pu déliter la marne. Tamisage ensuite à 50 microns.
Acide
chlorydrique.rinçages.permanganate potassium plus acide sulfurique puis
mélange d'acide chlorydrique et de péroxyde.rinçages.acide
nitrique. Bicarbonate de sodium et pour finir paillettes de savon.le
tout à chaud.5 à 8 rinçages entre chaque agent chimique.
le plus difficile n'est pas d'évacuer cette marne mais la gangue blanchâtre et dure qui enroble les
diatomées.Il s'agit ici de l'échantillon 4.Beaucoup de centrique avec
une prédominance de deux ou trois.Tous les T. favus sont cassés.traces
de quelques arachnoidiscus ainsi que d'Aulacodiscus (trés cassés). / D
Prades
- ".......... Pour
éliminer progressivement les particules minérales et isoler les
frustules on procède de la façon
suivante :
Ebullition de 2 g. de sédiment dans 100 ml d'eau oxygénée 110 volumes à
30% pendant 30 mn. On procède à des lavages répétés (au moins 10)
suivis de décantations de façon à éliminer progressivement les
particules minérales les plus lourdes et à ne conserver que les
frustules siliceux plus légers. On obtient ainsi un liquide fortement
enrichi en Diatomées dont on dépose une goutte sur une lamelle
circulaire. Après évaporation complète, on dépose sur la lamelle une goutte d'une résine à fort
indice de réfraction (Clearax, n=1,66), on chauffe et on applique une
lamelle sur une lame.
Dans le cas ou la roche est calcaire,
une attaque par HCl à froid est préalablement nécessaire.
Si la roche est argileuse il faut la défloculer au pyrophosphate puis au bout
d'une heure siphonner le liquide surnageant.
Enfin, si l'échantillon est très compact et cimenté il faut essayer de
le fragmenter (par cristallisation d'acétate fondu, par le gel,
etc...). Bien entendu ces méthodes ne sont pas les seules; un
fractionnement par liqueur dense peut être utile." Didier
- Voici la
façon dont je procède pour le nettoyage des diatomées
contenues dans la diatomite. /toucan
J’ai suivi les conseils avisés de Ferran pour arriver à un
résultat
exploitable, que je remercie encore.
Je me place ici uniquement concernant le traitement de la diatomite
provenant de St Laurent la Vernède. Donc pas pour des traitements
d’autres sources : eau
douces, eau de mer, par exemple.
Le protocole que je décris est un traitement relativement léger, il
fait surtout appel à de nombreux lavages rapides pour éliminer les
boues (marne) en suspension, pour ne recueillir en finale que le fond
qui recèle un maximum d’éléments intéressants, mais parmi aussi de
nombreux petits déchets ! Il faut dès lors ne pas trop concentrer les
diatomées dans la goutte prélevée pour avoir
le maximum de chance pour qu’elles soient isolées.
En fait cette diatomite ne contient pas de débris végétaux ou autres
qui nécessiteraient un traitement plus poussé aux acides
Traitement de la diatomite de St Laurent la
Vernède.
1. Prendre 1 gramme de
diatomite sèche.
2. Y ajouter 10cc d’acide
chlorhydrique du commerce (GB du coin)) dilué
à 50%. Cela mousse très fort. Ensuite chauffer à 70 à 80° C. pendant 1
heure. Laisser refroidir et ajouter de l’eau du robinet. L’ensemble est
bien dissous.
3. Ensuite une série de 6
lavages à l’eau du robinet (environ 50cc) Le
temps d’attente est réduit à 12 min. par cm de hauteur d’eau. Prélever
le fond et rejeter le surnageant. Ce surnageant est à contrôler sous
microscope mais il ne reste pratiquement aucune diatomée.
4. Sur le fond couvrir
d’eau oxygénée à 30% (110 volumes). La
proportion est de 10cc pour 1gr de diatomite sèche. D’abord à froid,
ensuite chauffer à 80° pendant 2 heures. Laisser refroidir et ajouter
de l’eau du robinet. Cela peut aussi mousser parfois.
5. Série de 8 lavages à
l’eau du robinet. Environ 50cc. Cette fois le
processus est différent : retirer le liquide trouble sans attendre que
tout se dépose au fond ; dès que l’on voit une concentration formée
dans le fond du récipient, retirer le liquide trouble, (surnageant) on
élimine ainsi l’argile fine qui tarde le plus à se déposer. Pour cela
agiter le contenu et après environ 40 sec. siphonner pour ne garder que
le fond et après contrôle jeter le surnageant.
6. Lavage final. 2 x à
l’eau déminéralisée du commerce. Même façon
d’opérer que en § 5 ci avant. L’examen du prélèvement final (le fond)
contient de grandes et petites diatomées
jusqu’ à 15 µm de diam. (et même moins) mais aussi les spicules qui
toutefois s’agglomèrent et relativement peu de déchets d’argiles. Il
est toutefois recommandé de stocker ce dernier prélèvement suffisamment
dilué pour qu’à l’examen sous microscope les diatomées
se chevauchent le moins possible. Si l’on constate qu’il reste encore
trop de déchets ne pas hésiter à faire quelques lavages
complémentaires. Un essai de nettoyage
complémentaire à l’acide nitrique à chaud n’apporte aucun bénéfice pour
améliorer la qualité finale.
7. Le concentré de diatomées est mis en
réserve avec 50% d’alcool à 90°.
PS. L’examen ultérieur du rejet des
surnageants montre qu’il reste très peu de diatomée parmi toute la
marne ou l’argile. /toucan
Le montage des
diatomées.
J’ai constaté à maintes reprises qu’il était difficile
d’avoir une
bonne répartition des diatomées sur la lame : soit des agglomérats localisés soit une
concentration excessive sur le pourtour de la goutte déposée.
Voici la façon dont je procède et qui me donne de bons résultats.
J’utilise de grandes lamelles de 22x22 mm. nettoyées à l’alcool à
brûler.
Je place mes lamelles sur une plaque chauffante froide.
(J’utilise une petite grillade électrique avec thermostat achetée pour
quelques euros dans une grande surface)
J’ai dépose 2 gouttes d’eau déminéralisée et ensuite j’y dépose dessus
3 gouttes d’alcool qui foisonnent et étalent la grosse goutte obtenue
sur une plus grande surface.
Enfin sur cette grosse goutte j’y dépose 1 goutte de diatomée.
Les diatomées se répartissent bien sur
toute la surface de cette grosse lentille.
(Pour rappel : cette goutte de diatomée est composée par
moitié d’eau
déminéralisée et par moitié d’alcool)
Ensuite je chauffe la plaque doucement en jouant sur le thermostat de
sorte que la plaque chauffe très lentement au début (on voit que les diatomées s’agitent et se déplacent un peu),
ensuite je porte la température au environ de 70 à 80°C (ici les diatomées ne bougent plus) que je laisse
refroidir doucement et je répète cette procédure jusqu’au séchage
complet.
J’estime que cela dure environ une dizaine de minutes.
La suite du montage est comme il est d’usage : la lame reçoit 2 à 3
gouttes de Styrax, Zrax ou Naphrax en son centre et on y dépose avec
soin la lamelle. On chauffe la lame doucement à environ 50°C. Jusqu’à
bullage de la résine et donc l’évaporation du diluant (Xylène, Xylol,
etc.…). Placer un petit poids sur la lamelle pour assurer une épaisseur
minimum de résine.
Mon expérience avec le Zrax me permet après 3 ou 4 jours de manipuler
la lame sans risque sous le microscope. Avant cela il faut être très
prudent lors de l’utilisation d’objectifs à fort grossissement, très
proches de la lamelle. /toucan
- ...
Nettoyage/désagrégation de la diatomite
- Une vraie diatomite est généralement une roche
friable, de couleur claire et de très faible densité (jusqu'à 0.5
sèche). Mais s'il y a des passages de diatomite, il doit surtout y
avoir des sédiments plus ou moins riches en diatomées (argiles, marnes,
limons, tufs calcaires...).
Comme ça n'est pas loin, autant faire une journée de reconnaissance
pour se familiariser avec les différents faciès accessibles et essayer
différentes techniques. Pour prospecter, un petit microscope de terrain
peut se révéler utile.
Pour le
traitement, par exemple attaque HCl à 10% ou acide acétique puis
H2O2. il y a des nombreuses techniques et il y a eu des messages sur le
sujet sur le forum. Éviter l'acide
sulfurique (formation de sulfate très peu soluble) et les
traitements trop violents.
Mais s'il s'agit bien de laminites silteuses le problème sera d'isoler
les frustules des grains détritiques, lavages, décantations...
/Pierre
M.
- Maraussan: à
moins d'être en présence d'une roche dure, compressée et infiltrée, on
peut très facilement (et très économiquement) dissocier la diatomite
dans une solution
tiède de Blanco
(oxydant blanchissant pour lessive de linges blancs), durant quelques
heures. Cela avait, en son temps, fait pouffer de rire et d'indignation
notre éternel et lassant contradicteur permanent, mais, à l'usage, voui
voui, cela marche très bien. C'est beaucoup moins dangereux que
d'utiliser l'eau oxygénée (peroxyde) concentrée. LeNat
- Maraussan: Le
Blanco (en solution dans de l'eau, faut-il le préciser ?) fait fonction
d'agent désagrégant. C'est tout, mais c'est déjà pas mal. C'est donc un
substitutif au Sodium hexametaphosphate. Si tu as du SHMP, inutile de
recourir au Blanco, évidence... On peut donc utiliser ce produit
économique sur le terrain, sans danger de manipulation. D'autres
techniques de désagrégation existent, donc la cryogénisation
multi-répétée, très efficace sur les diatomites dures (certains sites
d'Oamaru par exemple, ou celles de Karlovo, Bulgarie), mais c'est une
technique impraticable sur le terrain. La diatomite de St Laurent (tous
sites) est ainsi réduite en quelques heures, à froid.
En aucun
cas, par-contre, la désagrégation initiale ne remplace les traitements
ultérieurs classiques, du type à l'acide nitrique pur chaud, destinés à
éliminer les précipitations et les matières organiques... Mais
prudence, on change là totalement de catégorie de
manipulation.
Certains trouveront que la présentation d'un bidon de SHMP fait plus
"pro" que les dosettes de Blanco. C'est leur affaire. Personnellement,
j'utilise les 2 formes... le Blanco ayant l'avantage de pouvoir passer
facilement aux contrôles des vols aériens internationaux.
Références diatomées fossiles
7- Discussions
En dehors
de l’algue dont tu parles, as-tu aussi pêché au filet ?
Et, succinctement, quel est le traitement que tu as fait subir à ces
chères petites bêtes ?
On a aussi fait une récolte avec le filet
que l'on a laissé traîner derrière le bateau mais il y a beaucoup moins
de diatomées avec cette technique.
Peut-être faut-il revoir la technique ou bien est-ce la taille de la
maille qui n'est pas optimale ? Je ne sais pas trop...
Pour le traitement,
j'ai simplement fait un passage à l'eau de Javel puis
lavages et eau oxygénée 35% au bain-marie.
Après j'ai laissé un partie de la suspension sédimenter pendant
quelques minutes et j'ai récupérer le surnageant.
Cependant, je n'ai pas encore monter de diatomée avec cette dernière
étape, j'espère avoir des choses plus propres.
...
LeNat
Il s'agit là d'algues possédant une paroi en silice.
Si tu veux en récolter, tu peux prendre une algue ou frotter la surface des
roches afin de récupérer tous ce qui est fixé dessus.
Pour l'algue,
tu peux la laisser un peu de temps dans l'eau de Javel et ensuite la
comprimer afin de garder le liquide contenant les diatomées qui ont été
décrochées.
Le plus compliqué est de nettoyer les prélèvements afin de ne garder
que les paroi en silice, il faut détruire toute la matière organique et
éliminer les particules.
Cependant, on peut déjà faire plein d'observations - y compris en MEB -
sans avoir un échantillon parfaitement propre. Il peut rester quelques
débris qui pourront gêner l'observation mais en général on arrive
toujours à avoir quelques diatomées bien placées et bien propres.
BelialL
...
...
8- Culture de diatomées
Voir méthode Ferran LeNat
...
9- Préparation
des lames (esthétique)
Le travail se fait en 3 étapes distinctes.
- La première est le nettoyage trés rigoureux et drastique (capital
pour la suite) de lame et lamelle.
Ensuite intervient le moment de l'encollage (je possède deux types de
colle, une complètement synthétique je pense et l'autre à base de gomme
de Tragacanth , méthode des vieux diatomistes comme J.D.Möller et plus
récent comme K.D.Kemp).
L'application de celle ci m'a demandé pas mal de recherches et donc
d'échecs.
Le dosage est différent si je vais coller de grosses diatomées ou bien
de très fines et fragiles valves.
- La deuxième étape consiste à constituer le motif désiré (j'y pense à
l'avance si c'est une rosette part exemple).
Les diatomées issues de la solution mère sont disposées sur des lames
mères, et de là, je les attrape une par une, les nettoie car elles sont
souvent souillées de fines particules et les place sur la lame ou la
lamelle.
L'agencement est en régle générale souvent périlleux, une régle à ne
pas outrepasser est de ne pas casser une diatomées sur l'espace de
travail (souillures).
- Quand l'agencement est fini, on passe à la troisième étape qui est le
montage de la lamelle, puis et enfin le lutage...
Il faut que rien ne bouge, ce n'est pas toujours le cas.
Et suivant que j'utilise tel ou tel médium, mon protocole de montage
peut-être différent.
Voici pour les grandes lignes, il ne vous reste plus maintenant qu'à
vous essayer dans cette discipline...
(Pris dans mes
notes de 1972)
Colle entomologique de G. Tempère
:
Eau distillée 35g, Gomme acacia/arabique E414 25g (dans un nouet de
mousseline), Sirop de sucrose ou Lévulose 15g, Phénol 2g.
Colle à diamomées, radiolaires, foraminifères, spicules, écailles de
papillons ... d'indice proche du Baume. Pour la micrographie, on la
diluera beaucoup : une goutte dans 2 ou 3 cc d'eau distillée
(phéniquée). Etendre sur la lamelle avec une baguette de verre, en
couche mince que l'on laisse sécher. Au moment de l'emploi, on dispose
les objets à fixer, puis on projette doucement l'haleine pour faire
adhérer. On laisse enfin bien sécher, au besoin en chauffant modérément
sur plaque chauffante ou à l'étuve. Pour les diatomées en suspension
dans l'eau, il suffit d'ajouter au liquide (l'eau) une goutte de la
colle diluée, avant d'étendre.
Note: ce protocole
permet d'ajuster très finement la position de l'écaille sur la
préparation, l'écaille n'étant fixée définitivement qu'au dernier
moment. Mais il est aussi possible d'humidifier la colle AVANT de
déposer l'écaille, la fixation étant alors immédiate, mais sans
possibilité d'ajuster la position de celle-ci... c'est un choix à
faire. /Maraussan
...
Tout à
fait, avec cependant une précision : la technique de dépot présentée
dans la vidéo utilise la méthode dite "humide", alors que précédemment,
je décrivais sommairement la technique dite "sèche".
La technique "humide" présente certains inconvénients : elle capte à
volo les poussières atmosphériques d'une part, et d'autre-part, elle
peut engluer partiellement la diatomée d'un milieu d'indice différent
du complément qui sera ultérieurement déposé sur celle-ci. Lors de
l'observation, du fait des différences d'indice, la structure de la
diatomée peut être partiellement déformée. C'est sans réel inconvénient
pour un montage artistique, mais peut être génant pour une étude de
structure... /Maraussan
- Les premiers essais de D Prades: http://forum.mikroscopia.com/topic/4417-ma-premiere-lame-de-diatomees-micromanipulee/
(dilution colle, chouix des poils, ...)
- Il parait que le "poil" idéal pour ce genre de
montage serait le cil de porc.
- ...
...
...
Micromanipulateur
Voir une réalisation faite à partir d'un vieux
microscope... LeNat
A classer
Etude mathématique des formes
On peut aller voir la super formule: wiki https://en.wikipedia.org/wiki/Superformula

...
Je tiens à préciser
que les photos ne sont pas de moi, contrairement à ce que peut indiquer
le
cartouche en bas de page. (C'est mon système automatique qui me donne
ce message) Les auteurs des photos sont à chaque fois indiqués.
(sauf erreurs involontaires de ma part)
Ethymologie
| |
Racine Latine |
Exemples de noms |
Amphora;
Anthos;
Bacillum;
Biblos;
Calos;
Ceras; |
urne amphore
fleur
bare, baton
livre
beau
corne |
Amphora, Amphoropsis.
Anthodiscus, Achnanthes.
Bacillaria.
Biblarium.
Calodiscus, Caloneis.
Cerataulus, Triceratium |
| |
Racine Grecque |
|
Dens;
Discos;
Encyos;
Ethmos;
Fenestra;
Frustulum
Gramma;
Gyros;
Helios;
Homoios;
Isos;
Isthmos;
Lepidus;
Liber; (L)
Mastos;
Micros;
Navis; (L)
Noton;
Opsis;
Orthos;
Paralia;
Phoroa;
Rhoicos;
Rutilus;
Sigma ;
Stella ;
Tabella ;
Thrix;
Zygon; |
dent
Disque
Pregnante.
passoire
fenêtre
petit morceau
écrit
cercle, courbe
soleil
identique, similaire
egal
isthme
gracieux .
Libellé
sein
petit
navire
dos
apparence.
droit
marine.
sombre
courbé
brillant
(lettre grecque S)
étoile
(tabula) table.
cheveux.
paire. |
Denticella, Denticula.
Discosira, Discplea.
Encyonema.
Ethmodiscus
Fenestrella.
Frustulia.
Dimerogramma, Tetragramma.
Gyrosigma, Liparogyra.
Heliopelta.
Anomoeoneis, Homeoocladia.
Isodiscus, Anisodiscus.
Isthmia.
Lepidodiscus.
Libellus.
Mastognia, Mastodiscus.
Microneis, Micropdiscus.
Navicula.
Eunotia, Eunotogramma.
Amphoropsis, Rutilariopsis.
Anorthoneis, Orthotropis.
Paralia.
Phaeodactylon.
Rhoiconcis, Rhoicosphenia
Rutilariopsis, Rutilaria.
Pleurosigma, Gyrosigma.
Stelladiscus.
Tabellaria
Thalassiothrix Zoon; animal, Zotheca
Zygoceros. |
Dens; dent
Denticella, Denticula.
Discos; Disque
Discosira, Discplea.
Encyos; Pregnante. Encyonema.
Ethmos; passoire Ethmodiscus
Fenestra; fenêtre Fenestrella.
Frustulum ; petit morceau Frustulia.
Gramma; écrit
Dimerogramma, Tetragramma.
Gyros; cercle, courbe Gyrosigma, Liparogyra.
Helios; soleil
Heliopelta.
Homoios; identique, similaire Anomoeoneis, Homeoocladia.
Isos; egal
Isodiscus, Anisodiscus.
Isthmos; isthme Isthmia.
Lepidus; gracieux . Lepidodiscus.
Liber; (L) Libellé Libellus.
Mastos; sein
Mastognia, Mastodiscus.
Micros; petit
Microneis, Micropdiscus.
Navis; (L) navire Navicula.
Noton; dos
Eunotia, Eunotogramma.
Opsis; apparence. Amphoropsis, Rutilariopsis.
Orthos; droit
Anorthoneis, Orthotropis.
Paralia; marine. Paralia.
Phoroa; sombre Phaeodactylon.
Rhoicos; courbé Rhoiconcis, Rhoicosphenia
Rutilus; brillant
Rutilariopsis,
Rutilaria.
Sigma ;( lettre grecque S) Pleurosigma, Gyrosigma.
Stella ; étoile Stelladiscus.
Tabella ;(tabula) table. Tabellaria
Thrix; cheveux.
Thalassiothrix
Zoon; animal,
Zotheca.
Zygon; paire. Zygoceros.
.
Warning: main() [function.main]: open_basedir restriction in effect. File(../../../css/Footer.php) is not within the allowed path(s): (/mnt/159/sda/6/c/pichotjm) in /mnt/159/sda/6/c/pichotjm/Docu/Diatomees/1-CaptureDiatomees.php on line 2239
Warning: main(../../../css/Footer.php) [function.main]: failed to open stream: Operation not permitted in /mnt/159/sda/6/c/pichotjm/Docu/Diatomees/1-CaptureDiatomees.php on line 2239
Warning: main() [function.include]: Failed opening '../../../css/Footer.php' for inclusion (include_path='/mnt/159/sda/6/c/pichotjm/include:.:/usr/php4/lib/php') in /mnt/159/sda/6/c/pichotjm/Docu/Diatomees/1-CaptureDiatomees.php on line 2239